1.企业若需要自行实施UDI,生成UDI码的常规流程为:
申请厂商识别代码(DI)→编制 UDI-DI→编制 UDI-PI→赋码和校验→UDI 数据库录入→数据维护
第一步:申请厂商识别代码(DI)
首先企业需到中国物品编码中心申请厂商识别代码,点击“我要申请商品条码”,手机号绑定成功后,按照提示流程操作即可:
企业需提供营业执照并根据企业的类型:单个企业、集团企业、进出口企业来选择,通过中国物品编码中心3个工作日的审核周期,下发给企业9位的厂商识别代码,可满足企业添加1000个申请厂商代码线上办理。
第二步:编制 UDI-DI
接下来的工作是梳理企业的产品线,确定包装级别,根据自身情况编制UDI-DI 。
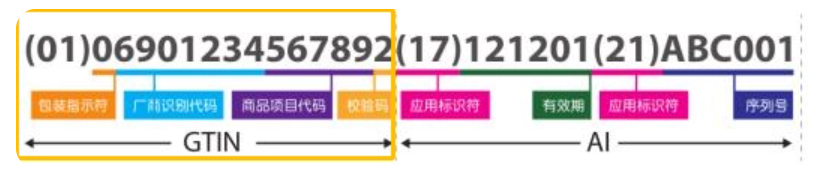
UDI-DI组成包括: 包装标识符+厂商识别代码+商品项目代码+校验码,具体图示如下:
之前我们在文章中讲过,UDI=DI+PI。
上图中黄色框线内的GTIN部分就是我们的DI,AI部分是我们的PI。
DI 指示符:(01)为 DI 指示符,固定不变;
包装识别符:由 1 位数字组成,0-9,0 代表基础包装或一层包装,1 代表二层包装,以此类推;
厂商识别代码:由中国物品编码中心分配(Step 1 中申请的厂商识别码),由 7至10 位数字组成;
商品项目代码:企业自行编辑,2至5 位数字组成;
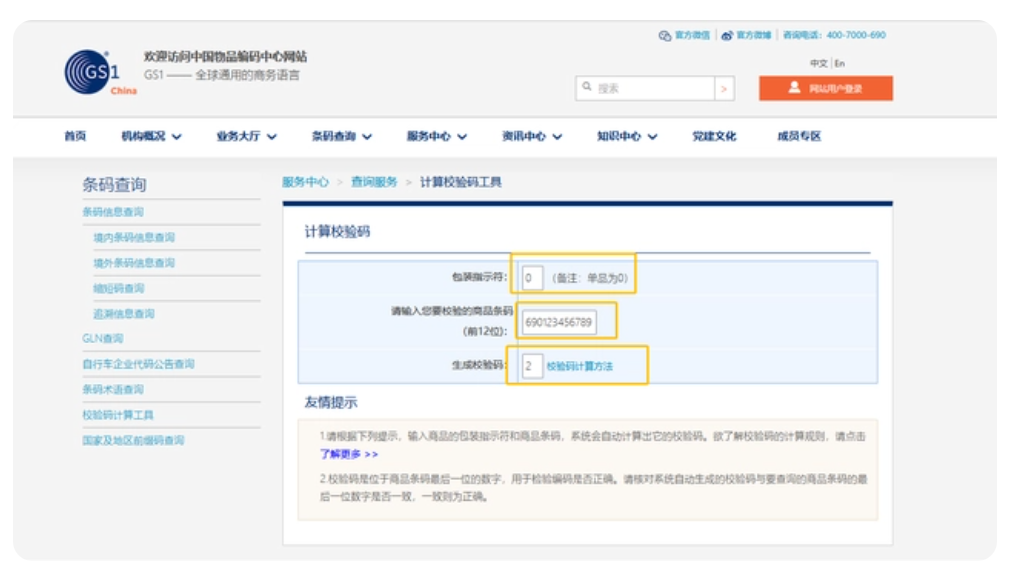
校验码:GS1 直接校验:输入包装指示符和要校验的商品条码后,会自动生成校验码。
第三步:编制 UDI-PI
根据《医疗器械唯一标识系统规则》第七条:“生产标识由医疗器械生产过程相关信息的代码组成,根据监管和实际应用需求,可包含医疗器械序列号、生产批号、生产日期、失效日期等。”企业可根据自身管理的需要、经营流通和使用单位记录使用的需要,自行选择。GS1 的 PI 的编码和范例如下:

第四步:赋码和校验
1) UDI 一维、二维条码和 RFID 标签的选择可参考《一文读懂:实施UDI时,数据载体应该如何选择?》
2)打码设备采购
3)标签合规检测
第五步:UDI 数据库录入
在国家药监局唯一标识注册系统、医疗器械唯一标识数据库(CUDID)中提交UDI数据。
上市销售前,企业应按照相关标准或者规范要求将最小销售单元、更高级别包装的产品标识和相关数据上传至医疗器械唯一标识数据库 。
第六步:数据维护
当医疗器械产品最小销售单元产品标识的相关数据发生变化时,企业应当在该产品上市销售前,在医疗器械唯一标识数据库中进行变更,实现数据更新。
同时做好医保、卫健委等相关平台上产品编码与UDI的关联。